Intrarosa®
Indication : Intrarosa® est indiqué pour le traitement local de l’atrophie vulvo-vaginale chez les femmes post-ménopausées.
Conditionnement : emballages de 28 et 84 ovules.
Introduction
Intrarosa® est le nom commercial de la prastérone, un médicament utilisé pour traiter l’atrophie vulvo-vaginale chez les femmes ménopausées. Il s’agit de l’unique thérapie sur prescription de 1ère ligne du SGUM (syndrome génito-urinaire de la ménopause) recommandé par les sociétés internationales 1, qui génère des œstrogènes et des androgènes. 1
La ménopause entraîne non seulement une baisse des œstrogènes mais aussi des androgènes, à l’origine du syndrome génito-urinaire de la ménopause.1 La littérature montre qu’en complément des œstrogènes, les androgènes jouent un rôle essentiel dans le maintien des propriétés physiologiques et morphologiques des tissus vulvovaginaux.2
La DHEA (déhydroépiandrostérone), en se convertissant en œstrogènes et androgènes, apparaît ainsi comme une solution complète pour la santé vulvovaginale.
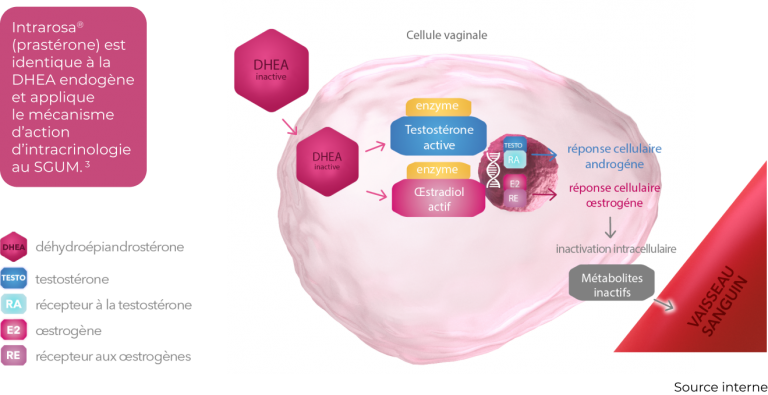
Mécanisme d’action
La substance active d’Intrarosa®, la prastérone, soit la DHEA, est identique à la DHEA endogène.
Une fois l’ovule Intrarosa® administré dans le vagin, la prastérone va être convertie localement en œstrogènes et androgènes, suivi de leur action locale.

Efficacité
Intrarosa® rétablit le fonctionnement normal et sain de l’épithélium. 5,7
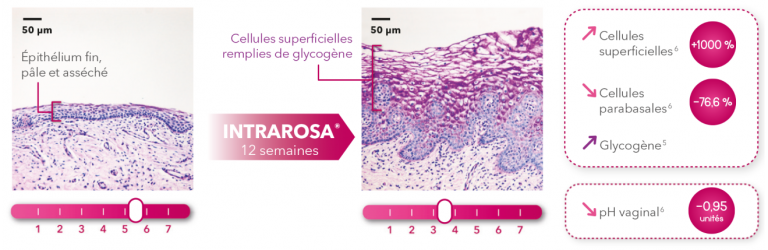
Variations en % (ou unités de pH)6 après 12 semaines de traitement par Intrarosa®. Étude clinique d’efficacité de Phase III prospective randomisée, en double aveugle, contre placebo. 558 patients sur 12 semaines. p values vs placebo p < 0,0001.
Coupes histologiques vaginales avant/après Intrarosa® (coloration Periodic Acid-Shiff)5 pour illustrer les améliorations démontrées cliniquement vs placebo après 12 semaines de traitement.6
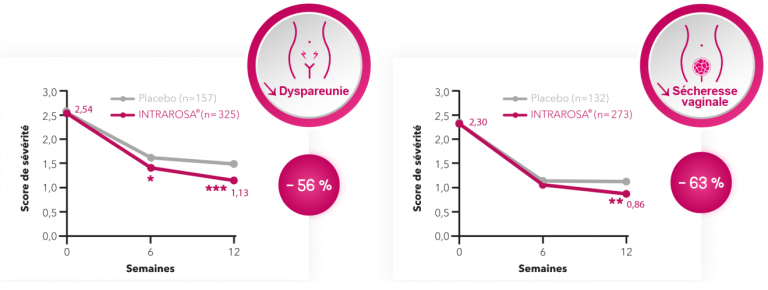
Adapté de Labrie et al 6.
p values vs placebo : * p < 0,05, ** p < 0,01, *** p < 0,001.
Variations en % des scores de sévérité après 12 semaines de traitement par Intrarosa®.
Les études cliniques démontrent aussi une amélioration de tous les domaines de la fonction sexuelle vs placebo après 12 semaines de traitement : 8

* p ≤ 0,05 ; ** p ≤ 0,01 ; *** p ≤ 0,001.
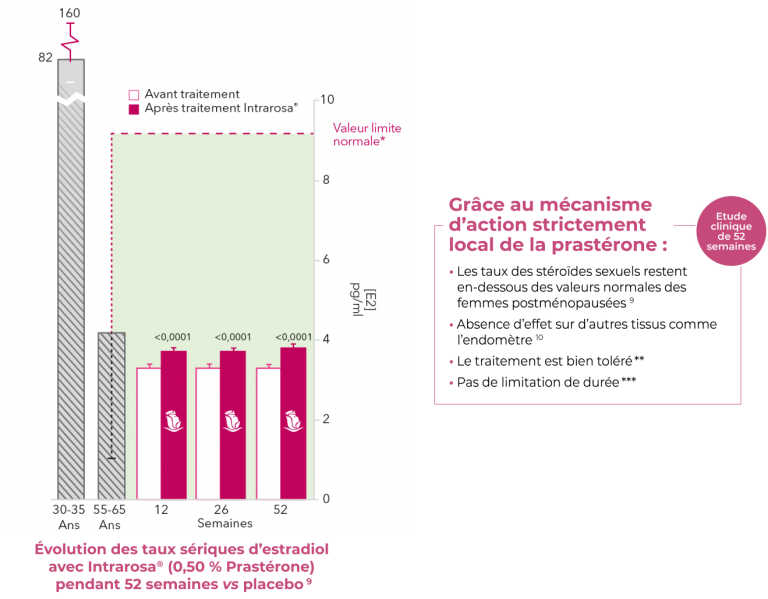
Sécurité
Les pertes vaginales constituent l’effet indésirable le plus couramment observé. Ceci s’explique par la fonte de la graisse solide utilisée comme excipient, qui s’ajoute à une augmentation prévisible des sécrétions vaginales en raison du traitement. Les effets indésirables les plus fréquents observés chez 1196 femmes lors de 6 études cliniques avec des ovules de 6,5 mg de prastérone sont : fluctuation de poids, pertes vaginales, frottis cervical anormal (principalement ASCUS ou LGSIL).
Intrarosa® garantit une sécurité systémique : 9
Posologie
La dose recommandée est un ovule d’Intrarosa® (6,5 mg prastérone) administrée une fois par jour, au coucher.

Ressources
AVV : atrophie vulvo-vaginale ; ASCUS : Atypical Squamous Cell of Unknowned Significance ; LGSIL : Low Grade Squamous Intraepithelial Lesion
& Traitement de prescription de 1ère ligne après les OTC.
* Seuil pour qu’un taux sérique d’E2 chez la femme ménopausée soit considéré comme normal.
** Les pertes vaginales constituent l’effet indésirable le plus couramment observé (Information professionnelle).
*** Une réévaluation doit être effectuée au moins une fois tous les six mois.
# Dans les études cliniques, l’efficacité du produit est significative après 3 mois de traitement, ce qui devrait être la durée minimale de traitement recommandée (en accord avec votre médecin). L’efficacité est maximale du produit a été obtenue dans les études cliniques à 6 mois de traitement. Après le début du traitement, consultez votre médecin au moins une fois tous les six mois (ou selon ses recommandations) pour vérifier si la poursuite du traitement par Intrarosa® est nécessaire. Il n’y a pas de limitation de durée pour Intrarosa®.
1. The NAMS 2020 GSM Position Statement Editorial Panel. The 2020 genitourinary syndrome of menopause position statement of The North American Menopause Society. Menopause. 2020 Sep;27(9):976-992.
2. Palacios, Santiago MD. Expression of androgen receptors in the structures of vulvovaginal tissue. Menopause 27(11):p 1336-1342, November 2020.
3. Labrie F, Labrie C. DHEA and intracrinology at menopause, a positive choice for evolution of the human species. Climacteric. 2013;16(2):205-213.
4. Labrie F, et al. Science of intracrinology in postmenopausal women. Menopause. 2017;24(6):702-712.
5. Bouchard C et al. Beneficial Effects of Intrarosa® (Vaginal Prasterone) on the Vaginal Histology of Women with VVA Treated or not with Aromatase Inhibitors: A Breakthrough in the Understanding of the Role of Androgens in Vaginal Health. Poster at ISSWSH Congress March 2022.
6. Labrie F, et al. Efficacy of intravaginal dehydroepiandrosterone (DHEA) on moderate to severe dyspareunia and vaginal dryness, symptoms of vulvovaginal atrophy, and of the genitourinary syndrome of menopause. Menopause. 2016;23(3):243-256.
7. Labrie F, et al. Combined data of intravaginal prasterone against vulvovaginal atrophy of menopause. Menopause. 2017;24(11):1246-1256.
8. Labrie F, et al. Effect of Intravaginal Prasterone on Sexual Dysfunction in Postmenopausal Women with Vulvovaginal Atrophy. J Sex Med. 2015;12(12):2401-2412.
9. Ke Y, Gonthier R et al. Serum steroids remain within the same normal postmenopausal values during 12-month intravaginal 0.50% DHEA. Horm Mol Biol Clin Investig. 2015 Dec;24(3):117-29.
10. Portman DJ, et al. Lack of effect of intravaginal dehydroepiandrosterone (DHEA, prasterone) on the endometrium in postmenopausal women. Menopause. 2015 Dec;22(12):1289-95
Intrarosa® :
Comp. : Prastérone 6,5 mg, graisse dure. Ind. : Traitement local de l’atrophie vulvo-vaginale chez les femmes post-ménopausées. P : 1 ovule par jour au coucher. CI : cancer du sein connu ou suspecté (ou antécédents); tumeurs malignes oestrogèno-dépendantes; hyperplasie endométriale; saignements génitaux; antécédents d’accident thromboembolique veineux ou artériel; troubles thrombophiliques; affection hépatique aiguë (ou antécédents); porphyrie; grossesse ; hypersensibilité au principe actif ou à l’excipient. MG : Motifs d’arrêt de traitement : céphalée, augmentation tension artérielle, ictère ou détérioration de la fonction hépatique, grossesse. Situations nécessitant une surveillance accrue : facteurs de risque de tumeurs oestrogèno-dépendantes, antécédents d’hyperplasie endométriale, fibromes utérins ou endométriose, facteurs de risque thromboembolique, migraine ou céphalée, hypertension, diabète sucré avec ou sans complications vasculaires, troubles hépatiques, lithiase biliaire, lupus érythémateux disséminé, asthme, épilepsie, otospongiose, rétention hydrique, hypertriglycéridémie. Les risques associés à un THS s’appliquent dans une moindre mesure à Intrarosa (à prendre en compte en cas d’utilisation prolongée du produit). Int. : substances avec effet inducteur sur les enzymes métabolisant les médicaments, en particulier le cytochrome P450. EI : pertes vaginales, frottis cervical anormal, fluctuation du poids. Prés. : emballage de 28 ovules (avec 6 applicateurs) et 84 ovules (avec 18 applicateurs). [B]. Labatec-Pharma S.A., 1217 Meyrin (Genève). De plus amples informations sur ce médicament sont disponibles sur : www.swissmedicinfo.ch.


